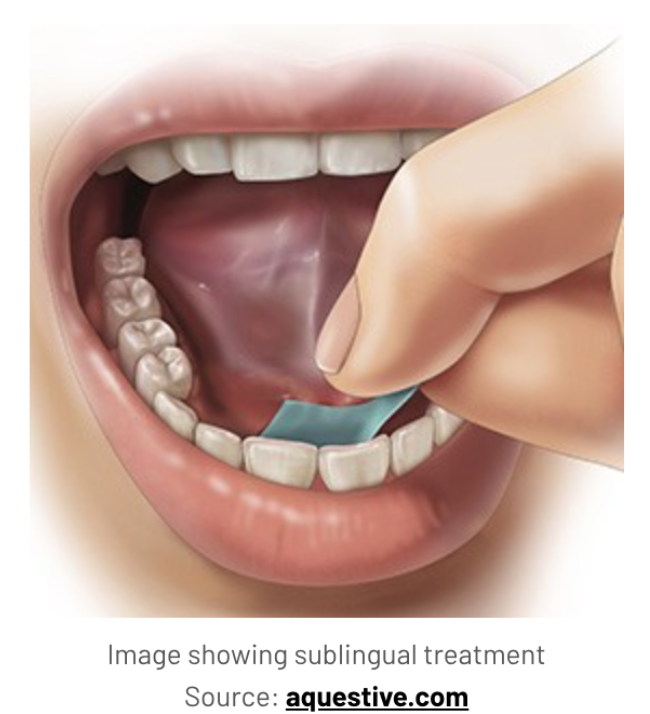
A Food and Drug Administration (FDA) nos Estados Unidos, está avaliando o Anaphylm, um filme oral de epinefrina que dissolve sob a língua — sem agulhas!
A Food and Drug Administration (FDA) nos Estados Unidos, está avaliando o Anaphylm, um filme oral de epinefrina que dissolve sob a língua — sem agulhas!
Rápido, prático e fácil de levar na carteira ou no bolso.
Age em apenas 12 minutos, mais rápido que os autoinjetores tradicionais.
Aprovado para adultos e crianças a partir de 30 kg.
Decisão da FDA sai até janeiro de 2026. Se aprovado, o Anaphylm pode revolucionar o tratamento da anafilaxia.
Na foto ao lado, o Anaphylm, produzido pela Aquestive. Essa foto foi tirada por Bianca Kirschner durante participação do Summit da FARE (Food Allergy Research and Education), em Orlando, em 2023
#Alergia #Anafilaxia #Epinefrina #Inovação #Saúde #FDA #Anaphylm #Emergência
Leia a noticia completa
FDA analisa película de epinefrina oral para possível aprovação
Por: Jenifer Goodwin em Alergia Alimentar, Notícias sobre Alergia Alimentar
Publicado em: 18 de junho de 2025:
A Food and Drug Administration (FDA) aceitou o pedido da Aquestive Therapeutics para um novo medicamento, um filme de epinefrina oral para tratar reações alérgicas graves. Chamado Anaphlym, o filme adere à membrana abaixo da língua e se dissolve rapidamente sem água.
A aceitação de um novo pedido pela FDA é uma etapa significativa no processo de aprovação de medicamentos. As empresas enviam um pedido após concluírem os ensaios clínicos que consideram necessários para a aprovação. A agência federal informou à Aquestive que tomará uma decisão sobre o produto de epinefrina até 31 de janeiro de 2026.
Daniel Barber, CEO da Aquestive Therapeutics “Estamos extremamente animados”, disse Daniel Barber, presidente e CEO da Aquestive, à Allergic Living. Se aprovado, o Anaphylm “vai salvar vidas. Pessoas que, de outra forma, não teriam um produto de epinefrina, terão um, e pessoas que, de outra forma, teriam esperado, o tomarão mais cedo. Ambos os cenários melhorarão os resultados”, afirma.
Com aproximadamente o tamanho de um selo postal, o Anaphylm pode ser guardado na carteira, no bolso ou na capa do celular. Cada pacote contém uma dose de 12 miligramas (mg) e é indicado para adultos e crianças com peso mínimo de 30 kg.
O alergista Dr. David Stukus, diretor do centro de alergia alimentar do Nationwide Children’s Hospital, afirmou que uma opção de película oral conveniente para transportar e sem agulha pode significar um uso mais oportuno da epinefrina.
“Embora a epinefrina continue sendo o único tratamento de primeira linha aprovado pela FDA, muitos indivíduos em risco não a carregam com frequência ou hesitam em usá-la quando os segundos contam”, afirma Stukus. “Uma abordagem oral sem agulha pode ser transformadora para o tratamento da anafilaxia.”
Velocidade da película de epinefrina oral elogiada
Um ensaio clínico crucial de Fase 3 da película solúvel incluiu 64 adultos. O estudo mostrou que o tempo mediano para o Anaphylm atingir a concentração máxima de epinefrina no sangue foi de 12 minutos. Esse tempo foi mais rápido do que o da EpiPen, que durou 20 minutos, do autoinjetor AUVI-Q, que durou 30 minutos, e da epinefrina administrada por seringa, que durou 50 minutos.
“Estamos claramente mais rápidos”, afirma o Dr. Carl Kraus, diretor médico da Aquestive. “É uma terapia de resgate, e a velocidade é um grande benefício para os pacientes. Poder colocar isso debaixo da língua e atingir esse nível em poucos minutos é maravilhoso para os pacientes.”
Um estudo pediátrico com 32 crianças de 7 a 17 anos apresentou resultados comparáveis.
Em um estudo adicional solicitado pelo FDA, o filme de epinefrina oral funcionou bem em pacientes com inchaço na boca devido à síndrome de alergia oral. A condição causa coceira e inchaço localizados na boca e na garganta após o consumo de certas frutas ou vegetais crus, como maçãs ou kiwi.
A FDA queria garantir que os sintomas orais, que também ocorrem durante a anafilaxia, não interferissem na absorção de epinefrina. Os resultados do estudo sobre alergia oral mostraram que o inchaço começou a diminuir dois minutos após a administração de Anaphylm. O tempo médio para a resolução completa dos sintomas foi de 12 minutos.
Próximos passos para o filme de epinefrina oral
Se aprovado, o Anaphylm se tornaria a segunda alternativa sem agulha aos autoinjetores de epinefrina nos EUA.
O primeiro a ser disponibilizado aos consumidores é o spray nasal de epinefrina neffy, da ARS Pharmaceuticals. Em agosto de 2024, a FDA aprovou uma dose de 2 mg de neffy para adultos e crianças com peso mínimo de 30 libras. Em março de 2025, uma dose de 1 mg de neffy foi aprovada para crianças com 4 anos ou mais e peso entre 30 e 66 libras.
Antes de sua decisão final sobre o filme oral, a FDA poderá convocar um comitê consultivo independente de especialistas para revisar os dados da empresa. A ARS Pharma passou por esse processo de revisão com o Neffy. Se tal reunião fosse realizada, Barber afirma que provavelmente seria no outono.
O CEO afirma que a acolheria com satisfação. As reuniões do comitê consultivo da FDA são abertas ao público e incluem representantes da comunidade de alergias, incluindo pacientes e grupos de defesa. “Seria uma ótima oportunidade para contarmos nossa história e garantir que divulgaremos nossos dados ao mundo”, afirma.
As famílias são convidadas a enviar comentários sobre quais produtos de epinefrina facilitariam suas vidas. “Está claro o que os pacientes desejam. Eles querem opções”, diz Barber. “Eles querem produtos que possam transportar sem atrapalhar suas vidas diárias. E querem produtos que funcionem em todos os cenários em que possam se encontrar.”
A pesquisa da Aquestive mostra que seu filme de epinefrina oral resiste a condições extremas. Isso inclui longos períodos em altas temperaturas, quando congelado ou após ser submerso em água.
Em um teste de calor extremo, com condições semelhantes às de um carro quente, o filme reteve 97% de sua potência após uma semana.
Quando o Anaphylm chegará às prateleiras das farmácias?
Se receber sinal verde, o Anaphylm poderá estar disponível para pacientes dentro de algumas semanas após a aprovação da FDA, afirma Barber. No entanto, a cobertura do seguro e a ampla conscientização por parte dos médicos levarão mais tempo.
Após a aprovação, a Aquestive realizará ações de conscientização entre famílias e profissionais de saúde. A empresa também mudará o foco para o desenvolvimento de uma dose menor para crianças de 13 a 30 kg.